ISO 15189:2022
(Main)Medical laboratories — Requirements for quality and competence
Medical laboratories — Requirements for quality and competence
This document specifies requirements for quality and competence in medical laboratories. This document is applicable to medical laboratories in developing their management systems and assessing their competence. It is also applicable for confirming or recognizing the competence of medical laboratories by laboratory users, regulatory authorities and accreditation bodies. This document is also applicable to point-of-care testing (POCT). NOTE International, national, or regional regulations or requirements can also apply to specific topics covered in this document.
Laboratoires médicaux — Exigences concernant la qualité et la compétence
Le présent document spécifie les exigences concernant la qualité et la compétence des laboratoires médicaux (laboratoires de biologie médicale et autres laboratoires médicaux comme les structures d’anatomie et de cytologie pathologiques). Le présent document est également applicable aux laboratoires médicaux dans le cadre de l’élaboration de leur système de management et de l’évaluation de leur compétence. Il est également applicable par les utilisateurs des laboratoires, les autorités réglementaires et les organismes d’accréditation pour confirmer ou reconnaître la compétence des laboratoires médicaux. Le présent document est applicable aux examens de biologie médicale délocalisée (EBMD). NOTE Des réglementations ou exigences internationales, nationales ou régionales peuvent également s’appliquer à des sujets spécifiques traités dans le présent document.
Medicinski laboratoriji - Zahteve za kakovost in kompetentnost
Ta dokument določa zahteve za kakovost in kompetentnost medicinskih laboratorijev.
Ta dokument uporabljajo laboratoriji pri oblikovanju sistemov upravljanja kakovosti in vrednotenju lastne kompetentnosti. Uporablja se tudi za potrjevanje ali prepoznavanje kompetentnosti medicinskih laboratorijev s strani laboratorijskih uporabnikov ter upravnih in akreditacijskih organov.
Ta dokument se uporablja tudi za testiranje ob pacientu (POCT).
OPOMBA: Za določene teme, ki so zajete v tem dokumentu, lahko veljajo tudi mednarodni, nacionalni ali regionalni predpisi ali zahteve.
General Information
Relations
Standards Content (Sample)
SLOVENSKI STANDARD
01-januar-2023
Medicinski laboratoriji - Zahteve za kakovost in kompetentnost
Medical laboratories - Requirements for quality and competence
Laboratoires de biologie médicale - Exigences concernant la qualité et la compétence
Ta slovenski standard je istoveten z: ISO 15189:2022
ICS:
03.120.10 Vodenje in zagotavljanje Quality management and
kakovosti quality assurance
11.100.01 Laboratorijska medicina na Laboratory medicine in
splošno general
2003-01.Slovenski inštitut za standardizacijo. Razmnoževanje celote ali delov tega standarda ni dovoljeno.
INTERNATIONAL ISO
STANDARD 15189
Fourth edition
2022-12
Medical laboratories — Requirements
for quality and competence
Laboratoires de biologie médicale — Exigences concernant la qualité
et la compétence
Reference number
© ISO 2022
All rights reserved. Unless otherwise specified, or required in the context of its implementation, no part of this publication may
be reproduced or utilized otherwise in any form or by any means, electronic or mechanical, including photocopying, or posting on
the internet or an intranet, without prior written permission. Permission can be requested from either ISO at the address below
or ISO’s member body in the country of the requester.
ISO copyright office
CP 401 • Ch. de Blandonnet 8
CH-1214 Vernier, Geneva
Phone: +41 22 749 01 11
Email: copyright@iso.org
Website: www.iso.org
Published in Switzerland
ii
Contents Page
Foreword . vi
Introduction .vii
1 Scope . 1
2 Normative references . 1
3 Terms and definitions . 1
4 General requirements . 8
4.1 Impartiality . 8
4.2 Confidentiality . 8
4.2.1 Management of information . 8
4.2.2 Release of information . 9
4.2.3 Personnel responsibility . 9
4.3 Requirements regarding patients . 9
5 Structural and governance requirements . 9
5.1 Legal entity . 9
5.2 Laboratory director . 10
5.2.1 Laboratory director competence . 10
5.2.2 Laboratory director responsibilities . 10
5.2.3 Delegation of duties . 10
5.3 Laboratory activities . 10
5.3.1 General . 10
5.3.2 Conformance with requirements . 10
5.3.3 Advisory activities . 10
5.4 Structure and authority . 11
5.4.1 General . 11
5.4.2 Quality management . 11
5.5 Objectives and policies . 11
5.6 Risk management .12
6 Resource requirements .12
6.1 General .12
6.2 Personnel .12
6.2.1 General .12
6.2.2 Competence requirements .12
6.2.3 Authorization .13
6.2.4 Continuing education and professional development .13
6.2.5 Personnel records. 13
6.3 Facilities and environmental conditions . 13
6.3.1 General .13
6.3.2 Facility controls . 14
6.3.3 Storage facilities . 14
6.3.4 Personnel facilities . 14
6.3.5 Sample collection facilities . 14
6.4 Equipment . 15
6.4.1 General .15
6.4.2 Equipment requirements . 15
6.4.3 Equipment acceptance procedure . 15
6.4.4 Equipment instructions for use . 15
6.4.5 Equipment maintenance and repair . 15
6.4.6 Equipment adverse incident reporting . 16
6.4.7 Equipment records . 16
6.5 Equipment calibration and metrological traceability . 17
6.5.1 General . 17
6.5.2 Equipment calibration . 17
iii
6.5.3 Metrological traceability of measurement results . 17
6.6 Reagents and consumables . 18
6.6.1 General . 18
6.6.2 Reagents and consumables — Receipt and storage . 18
6.6.3 Reagents and consumables — Acceptance testing . 18
6.6.4 Reagents and consumables — Inventory management . . 18
6.6.5 Reagents and consumables — Instructions for use . 19
6.6.6 Reagents and consumables — Adverse incident reporting . 19
6.6.7 Reagents and consumables — Records . 19
6.7 Service agreements . 19
6.7.1 Agreements with laboratory users . 19
6.7.2 Agreements with POCT operators . 19
6.8 Externally provided products and services . 20
6.8.1 General .20
6.8.2 Referral laboratories and consultants . 20
6.8.3 Review and approval of externally provided products and services .20
7 Process requirements .21
7.1 General . 21
7.2 Pre-examination processes . 21
7.2.1 General . 21
7.2.2
...
INTERNATIONAL ISO
STANDARD 15189
Fourth edition
2022-12
Medical laboratories — Requirements
for quality and competence
Laboratoires de biologie médicale — Exigences concernant la qualité
et la compétence
Reference number
© ISO 2022
All rights reserved. Unless otherwise specified, or required in the context of its implementation, no part of this publication may
be reproduced or utilized otherwise in any form or by any means, electronic or mechanical, including photocopying, or posting on
the internet or an intranet, without prior written permission. Permission can be requested from either ISO at the address below
or ISO’s member body in the country of the requester.
ISO copyright office
CP 401 • Ch. de Blandonnet 8
CH-1214 Vernier, Geneva
Phone: +41 22 749 01 11
Email: copyright@iso.org
Website: www.iso.org
Published in Switzerland
ii
Contents Page
Foreword . vi
Introduction .vii
1 Scope . 1
2 Normative references . 1
3 Terms and definitions . 1
4 General requirements . 8
4.1 Impartiality . 8
4.2 Confidentiality . 8
4.2.1 Management of information . 8
4.2.2 Release of information . 9
4.2.3 Personnel responsibility . 9
4.3 Requirements regarding patients . 9
5 Structural and governance requirements . 9
5.1 Legal entity . 9
5.2 Laboratory director . 10
5.2.1 Laboratory director competence . 10
5.2.2 Laboratory director responsibilities . 10
5.2.3 Delegation of duties . 10
5.3 Laboratory activities . 10
5.3.1 General . 10
5.3.2 Conformance with requirements . 10
5.3.3 Advisory activities . 10
5.4 Structure and authority . 11
5.4.1 General . 11
5.4.2 Quality management . 11
5.5 Objectives and policies . 11
5.6 Risk management .12
6 Resource requirements .12
6.1 General .12
6.2 Personnel .12
6.2.1 General .12
6.2.2 Competence requirements .12
6.2.3 Authorization .13
6.2.4 Continuing education and professional development .13
6.2.5 Personnel records. 13
6.3 Facilities and environmental conditions . 13
6.3.1 General .13
6.3.2 Facility controls . 14
6.3.3 Storage facilities . 14
6.3.4 Personnel facilities . 14
6.3.5 Sample collection facilities . 14
6.4 Equipment . 15
6.4.1 General .15
6.4.2 Equipment requirements . 15
6.4.3 Equipment acceptance procedure . 15
6.4.4 Equipment instructions for use . 15
6.4.5 Equipment maintenance and repair . 15
6.4.6 Equipment adverse incident reporting . 16
6.4.7 Equipment records . 16
6.5 Equipment calibration and metrological traceability . 17
6.5.1 General . 17
6.5.2 Equipment calibration . 17
iii
6.5.3 Metrological traceability of measurement results . 17
6.6 Reagents and consumables . 18
6.6.1 General . 18
6.6.2 Reagents and consumables — Receipt and storage . 18
6.6.3 Reagents and consumables — Acceptance testing . 18
6.6.4 Reagents and consumables — Inventory management . . 18
6.6.5 Reagents and consumables — Instructions for use . 19
6.6.6 Reagents and consumables — Adverse incident reporting . 19
6.6.7 Reagents and consumables — Records . 19
6.7 Service agreements . 19
6.7.1 Agreements with laboratory users . 19
6.7.2 Agreements with POCT operators . 19
6.8 Externally provided products and services . 20
6.8.1 General .20
6.8.2 Referral laboratories and consultants . 20
6.8.3 Review and approval of externally provided products and services .20
7 Process requirements .21
7.1 General . 21
7.2 Pre-examination processes . 21
7.2.1 General . 21
7.2.2 Laboratory information for patients and users . 21
7.2.3 Requests for providing laboratory examinations . 21
7.2.4 Primary sample collection and handling .22
7.2.5 Sample transportation .23
7.2.6 Sample receipt . 24
7.2.7 Pre-examination handling, preparation, and storage.
...
NORME ISO
INTERNATIONALE 15189
Quatrième édition
2022-12
Laboratoires médicaux — Exigences
concernant la qualité et la compétence
Medical laboratories — Requirements for quality and competence
Laboratorios clínicos — Requisitos para la calidad y la competencia
Numéro de référence
DOCUMENT PROTÉGÉ PAR COPYRIGHT
© ISO 2022
Tous droits réservés. Sauf prescription différente ou nécessité dans le contexte de sa mise en œuvre, aucune partie de cette
publication ne peut être reproduite ni utilisée sous quelque forme que ce soit et par aucun procédé, électronique ou mécanique,
y compris la photocopie, ou la diffusion sur l’internet ou sur un intranet, sans autorisation écrite préalable. Une autorisation peut
être demandée à l’ISO à l’adresse ci-après ou au comité membre de l’ISO dans le pays du demandeur.
ISO copyright office
Case postale 401 • Ch. de Blandonnet 8
CH-1214 Vernier, Genève
Tél.: +41 22 749 01 11
E-mail: copyright@iso.org
Web: www.iso.org
Publié en Suisse
ii
Sommaire Page
Avant-propos . vi
Introduction .vii
1 Domaine d'application .1
2 Références normatives .1
3 Termes et définitions . 1
4 Exigences générales . .8
4.1 Impartialité . 8
4.2 Confidentialité . 9
4.2.1 Gestion de l’information . 9
4.2.2 Communication des informations . 9
4.2.3 Responsabilités du personnel . 9
4.3 Exigences relatives aux patients . 9
5 Exigences structurelles et de gouvernance .10
5.1 Entité légale . 10
5.2 Directeur de laboratoire . 10
5.2.1 Compétences du directeur de laboratoire . 10
5.2.2 Responsabilités du directeur de laboratoire . 10
5.2.3 Délégation des missions et/ou responsabilités . . 10
5.3 Activités du laboratoire . 10
5.3.1 Généralités . 10
5.3.2 Conformité aux exigences . 10
5.3.3 Prestations de conseils . 11
5.4 Structure et autorité . 11
5.4.1 Généralités . 11
5.4.2 Management de la qualité . 11
5.5 Objectifs et politiques . 11
5.6 Gestion des risques .12
6 Exigences relatives aux ressources .12
6.1 Généralités .12
6.2 Personnel .12
6.2.1 Généralités .12
6.2.2 Exigences relatives aux compétences . 13
6.2.3 Autorisation .13
6.2.4 Formation continue et développement professionnel . .13
6.2.5 Enregistrements relatifs au personnel . 13
6.3 Installations et conditions environnementales . 14
6.3.1 Généralités . 14
6.3.2 Maîtrise des installations . 14
6.3.3 Installations de stockage . 14
6.3.4 Installations destinées au personnel . 15
6.3.5 Installations destinées au prélèvement des échantillons .15
6.4 Équipements . 15
6.4.1 Généralités .15
6.4.2 Exigences relatives aux équipements . 15
6.4.3 Procédure d’acceptation des équipements . 16
6.4.4 Équipements — Mode d’emploi . 16
6.4.5 Maintenance et réparations des équipements . 16
6.4.6 Signalement des événements indésirables relatifs aux équipements . 16
6.4.7 Enregistrements relatifs aux équipements . 17
6.5 Étalonnage des équipements et traçabilité métrologique . 17
6.5.1 Généralités . 17
6.5.2 Étalonnage des équipements . 17
iii
6.5.3 Traçabilité métrologique des résultats de mesure . 18
6.6 Réactifs et consommables . 19
6.6.1 Généralités . 19
6.6.2 Réactifs et consommables — Réception et stockage . 19
6.6.3 Réactifs et consommables — Essais d’acceptation . 19
6.6.4 Réactifs et consommables — Gestion des stocks . 19
6.6.5 Réactifs et consommables — Mode d’emploi . 19
6.6.6 Réactifs et consommables — Signalement des événements indésirables . 19
6.6.7 Réactifs et consommables — Enregistrements . 20
6.7 Contrats de prestations .20
6.7.1 Contrats avec les utilisateurs du laboratoire . 20
6.7.2 Contrats avec les opérateurs d’EBMD . 20
6.8 Produits et services fournis par des prestataires externes . 20
6.8.1 Généralités .20
6.8.2 Laboratoires sous-traitants et consultants . 21
6.8.3 Revue et approbation des produits et services fournis par des prestataires
externes . 21
7 Exigences relatives aux processus .21
7.1 Généralités . 21
7.2 Processus préanalytiques .22
7.2.1 Généralités .22
7.2.2 Informations du laboratoire à destination des patients et utilisateurs .22
7.2.3 Demandes d’examens auprès du laboratoire médical .22
7.2.4 Prélèvement et manipulation des échantillons primaires .23
7.2.5 Transport des échantillons . 24
7.2.6 Réception des échantillons . 25
7.2.7 Manipulation préanalytique, préparation et stockage . .25
7.3 Processus analytiques .26
7.3.1 Généralités .
...
NORME ISO
INTERNATIONALE 15189
Redline version
compare la Quatrième
édition à la Troisième édition
Laboratoires médicaux — Exigences
concernant la qualité et la compétence
Medical laboratories — Requirements for quality and competence
Laboratorios clínicos — Requisitos para la calidad y la competencia
Numéro de référence
ISO15189:r edline:2022(F)
ISO15189:redline:2022(F)
IMPORTANT — PLEASE NOTE
This is a provisional mark-up copy and uses the following colour coding:
Text example 1 — indicates added text (in green)
— indicates removed text (in red)
Text example 2
— indicates added graphic figure
— indicates removed graphic figure
1.x . — Heading numbers containg modifications are highlighted in yellow in
the Table of Contents
All changes in this document have yet to reach concensus by vote and as such should only
be used internally for review purposes.
DISCLAIMER
This Redline version is not an official IEC Standard and is intended only to provide the
user with an indication of what changes have been made to the previous version. Only the
current version of the standard is to be considered the official document.
This Redline version provides you with a quick and easy way to compare all the changes
between this standard and its previous edition. A vertical bar appears in the margin
wherever a change has been made. Additions and deletions are displayed in red, with
deletions being struck through.
DOCUMENT PROTÉGÉ PAR COPYRIGHT
© ISO 2022
Tous droits réservés. Sauf prescription différente ou nécessité dans le contexte de sa mise en œuvre, aucune partie de cette
publication ne peut être reproduite ni utilisée sous quelque forme que ce soit et par aucun procédé, électronique ou mécanique,
y compris la photocopie, ou la diffusion sur l’internet ou sur un intranet, sans autorisation écrite préalable. Une autorisation peut
être demandée à l’ISO à l’adresse ci-après ou au comité membre de l’ISO dans le pays du demandeur.
ISO copyright office
Case postale 401 • Ch. de Blandonnet 8
CH-1214 Vernier, Genève
Tél.: +41 22 749 01 11
E-mail: copyright@iso.org
Web: www.iso.org
Publié en Suisse
ii
ISO15189:redline:2022(F)
Sommaire Page
Avant-propos .viii
Introduction .x
1 Domaine d'application .1
2 Références normatives .1
3 Termes et définitions . 1
4 Exigences générales . .12
4.1 Impartialité .12
4.2 Confidentialité .12
4.2.1 Gestion de l’information .12
4.2.2 Communication des informations . 13
4.2.3 Responsabilités du personnel . 13
4.3 Exigences relatives aux patients . 13
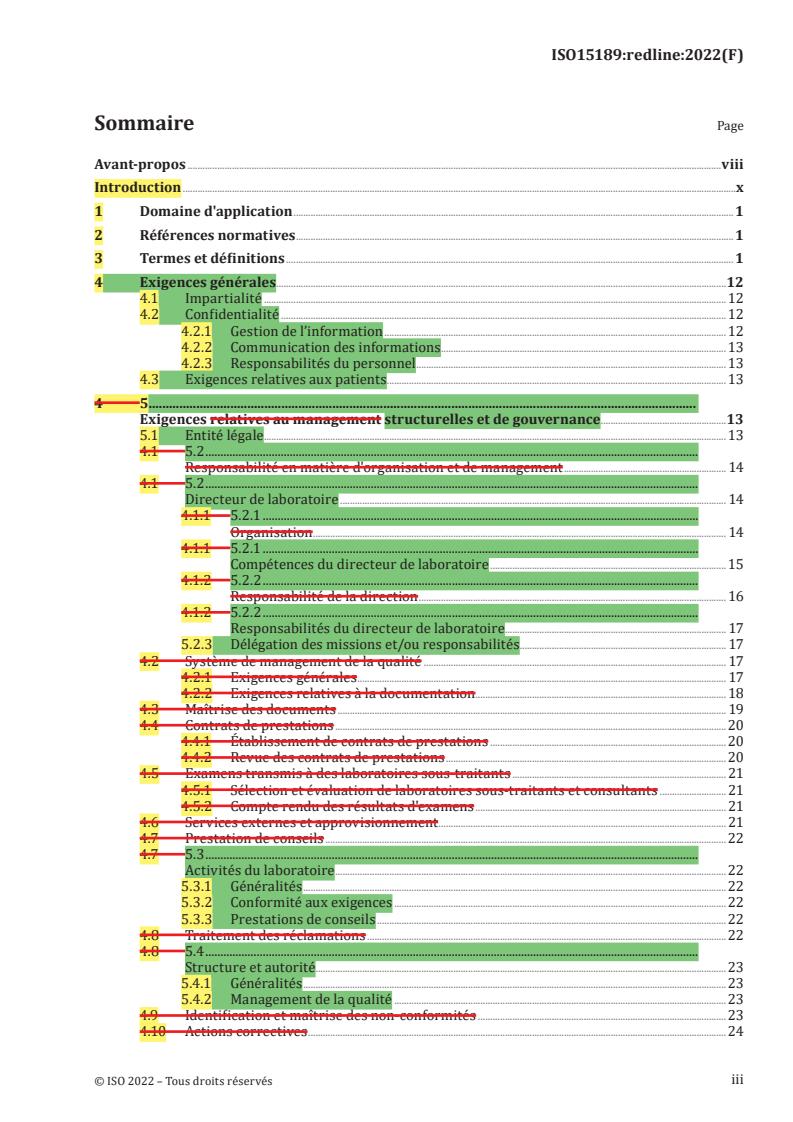
4 5 .
Exigences relatives au management structurelles et de gouvernance .13
5.1 Entité légale . 13
4.1 5.2 .
Responsabilité en matière d'organisation et de management . 14
4.1 5.2 .
Directeur de laboratoire . 14
4.1.1 5.2.1 .
Organisation . 14
4.1.1 5.2.1 .
Compétences du directeur de laboratoire . 15
4.1.2 5.2.2 .
Responsabilité de la direction . 16
4.1.2 5.2.2 .
Responsabilités du directeur de laboratoire . 17
5.2.3 Délégation des missions et/ou responsabilités . . 17
4.2 Système de management de la qualité . 17
4.2.1 Exigences générales . 17
4.2.2 Exigences relatives à la documentation . . 18
4.3 Maîtrise des documents . 19
4.4 Contrats de prestations .20
4.4.1 Établissement de contrats de prestations . 20
4.4.2 Revue des contrats de prestations . 20
4.5 Examens transmis à des laboratoires sous-traitants . 21
4.5.1 Sélection et évaluation de laboratoires sous-traitants et consultants . 21
4.5.2 Compte rendu des résultats d'examens . 21
4.6 Services externes et approvisionnement . 21
4.7 Prestation de conseils . 22
4.7 5.3 .
Activités du laboratoire . 22
5.3.1 Généralités .22
5.3.2 Conformité aux exigences . 22
5.3.3 Prestations de conseils . 22
4.8 Traitement des réclamations .22
4.8 5.4 .
Structure et autorité . 23
5.4.1 Généralités .23
5.4.2 Management de la qualité . 23
4.9 Identification et maîtrise des non-conformités . 23
4.10 Actions correctives . 24
iii
ISO15189:redline:2022(F)
4.11 Actions préventives . 24
4.12 Amélioration continue .25
4.13 Maîtrise des enregistrements .25
4.14 Évaluation et audits.26
4.14.1 Généralités . 26
4.14.2 Revue périodique des prescriptions, de la pertinence des procédures et
exigences concernant les échantillons . 27
4.14.3 Évaluation des retours d'informations de la part des utilisateurs . 27
4.14.4 Suggestions du personnel . 27
4.14.5 Audit interne . 27
4.14.6 Gestion des risques .28
4.14.7 Indicateurs qualité.28
4.14.8 Revues par des organisations externes .28
4.14 5.5 .
Objectifs et politiques .28
4.15 Revue de direction .29
4.15.1 Généralités .29
4.15.2 Éléments d'entrée de la revue .29
4.15.3 Activités de revue .29
4.15.4 Éléments de sortie de la revue .30
4.15 5.6 .
...
Deleted: /TC 212¶
Date: 2022-10-12¶
ISO/FDIS
Quatrième édition
Deleted: ISO/TC 212¶
Secrétariat: ANSI¶
2022-12
Date: 2023-01-04
Laboratoires médicaux — Exigences concernant la qualité et la
compétence
Medical laboratories — Requirements for quality and competence
Laboratorios clínicos — Requisitos para la calidad y la competencia
Deleted: Section Break (Next Page)
DOCUMENT PROTÉGÉ PAR COPYRIGHT¶
Deleted: /FDIS
Tous droits réservés. Sauf prescription différente ou nécessité dans le contexte de sa mise en oeuvre, aucune partie
Deleted: Droits de reproduction
de cette publication ne peut être reproduite ni utilisée sous quelque forme que ce soit et par aucun procédé,
Deleted: indication contraire
électronique ou mécanique, y compris la photocopie, ou la diffusion sur l’internet ou sur un intranet, sans
Deleted: l’affichage
autorisation écrite préalable. Une autorisation peut être demandée à l’ISO à l’adresse ci-après ou au comité membre
de l’ISO dans le pays du demandeur.
Deleted: Les demandes d’autorisation peuvent
Deleted: adressées
ISO copyright office
CP 401 • Ch. de Blandonnet 8
Deleted: • CP 401
CH-1214 Vernier, Geneva
Deleted: , Switzerland
Phone: + 41 22 749 01 11
Deleted: Tel.
E-mail: copyright@iso.org
Website: www.iso.org
Deleted: Fax + 41 22 749 09 47¶
Publié en Suisse
ii
Deleted: /FDIS
Deleted: /FDIS
Avant-propos
L'ISO (Organisation internationale de normalisation) est une fédération mondiale d'organismes Deleted: Organization
nationaux de normalisation (comités membres de l'ISO). L'élaboration des Normes internationales est en
Deleted: normalization
général confiée aux comités techniques de l'ISO. Chaque comité membre intéressé par une étude a le droit
Deleted: normalization
de faire partie du comité technique créé à cet effet. Les organisations internationales, gouvernementales
et non gouvernementales, en liaison avec l'ISO participent également aux travaux. L'ISO collabore
étroitement avec la Commission électrotechnique internationale (IEC) en ce qui concerne la
normalisation électrotechnique. Deleted: normalization
Les procédures utilisées pour élaborer le présent document et celles destinées à sa mise à jour sont
Deleted: utilizées
décrites dans les Directives ISO/IEC, Partie 1. Il convient, en particulier, de prendre note des différents
critères d'approbation requis pour les différents types de documents ISO. Le présent document a été
rédigé conformément aux règles de rédaction données dans les Directives ISO/IEC, Partie 2 (voir
www.iso.org/directives).
L'attention est attirée sur le fait que certains des éléments du présent document peuvent faire l'objet de
droits de propriété intellectuelle ou de droits analogues. L'ISO ne saurait être tenue pour responsable de
ne pas avoir identifié de tels droits de propriété et averti de leur existence. Les détails concernant les
références aux droits de propriété intellectuelle ou autres droits analogues identifiés lors de l'élaboration
du document sont indiqués dans l'Introduction et/ou dans la liste des déclarations de brevets reçues par
l'ISO (voir www.iso.org/brevets).
Les appellations commerciales éventuellement mentionnées dans le présent document sont données
pour information, par souci de commodité, à l’intention des utilisateurs et ne sauraient constituer un Deleted: utilizateurs
engagement.
Pour une explication de la nature volontaire des normes, la signification des termes et expressions
spécifiques de l'ISO liés à l'évaluation de la conformité, ou pour toute information au sujet de l'adhésion
de l'ISO aux principes de l’Organisation mondiale du commerce (OMC) concernant les obstacles Deleted: l’Organization
techniques au commerce (OTC), voir www.iso.org/avant-propos.
Deleted: le lien suivant:
Field Code Changed
Le présent document a été élaboré par le comité technique ISO/TC 212, Laboratoires de biologie médicale
et systèmes de diagnostic in vitro, en collaboration avec le comité technique CEN/TC 140, Dispositifs Deleted: iso/fr/
médicaux de diagnostic in vitro, du Comité européen de normalisation (CEN), conformément à l’Accord de
Deleted: -
coopération technique entre l’ISO et le CEN (Accord de Vienne).
Deleted: .html
Deleted: normalization
Cette quatrième édition annule et remplace la troisième édition (ISO 15189:2012), qui a fait l’objet d’une
révision technique. Elle remplace également l’ISO 22870:2016.
Les principales modifications sont les suivantes:
— à la suite de l’alignement avec l’ISO/IEC 17025:2017, les exigences relatives au management
Deleted: —
apparaissent désormais à la fin du document;
— les exigences relatives aux examens de biologie médicale délocalisée (EBMD), qui figuraient dans
Deleted: —
l’ISO 22870, ont été intégrées à la norme;
Deleted: délocalizée
— l’accent est davantage mis sur la gestion des risques.
Deleted: —
Il convient que l’utilisateur adresse tout retour d’information ou toute question concernant le présent Deleted: l’utilizateur
document à l’organisme national de normalisation de son pays. Une liste exhaustive desdits organismes
Deleted: normalization
se trouve à l’adresse www.iso.org/fr/members.html.
iv
Deleted: /FDIS
Introduction
L’objectif du présent document est d’améliorer la prise en charge des patients et la satisfaction des
utilisateurs des laboratoires par la confiance dans la qualité et la compétence des laboratoires médicaux. Deleted: utilizateurs
Le présent document rassemble les exigences applicables au laboratoire médical pour la planification et
la mise en œuvre d’actions pour prévenir les risques et profiter d’opportunités d’amélioration. L’intérêt
de cette approche est: l’amélioration de l’efficacité du système de management, la diminution du risque
d’obtenir des résultats non valides, et la réduction du risque de mise en danger des patients, du personnel
du laboratoire, du public et de l’environnement.
Les exigences en matière de gestion des risques sont alignées sur les principes de l’ISO 22367.
Les exigences relatives à la sécurité dans les laboratoires sont alignées sur les principes de l’ISO 15190.
Les exigences relatives au prélèvement des échantillons et à leur transport sont alignées sur l’ISO 20658 .
Le présent document rassemble également les exigences relatives aux examens de biologie médicale
délocalisée (EBMD) et remplace l’ISO 22870, qui sera retirée à la publication du présent document. Deleted: délocalizée
Deleted: annulée
La structure du présent document est basée sur celle de l’ISO/IEC 17025:2017.
Le laboratoire médical est un acteur essentiel dans le parcours de soins des patients; ses activités sont
réalisées dans un cadre éthique et soumises à une gouvernance, qui reconnaît les obligations des
prestataires de santé vis-à-vis du patient. Ses activités sont effectuées dans des délais appropriés pour
satisfaire les besoins de tous les patients et du personnel responsable de la prise en charge des patients.
Parmi les activités figurent la demande des examens, la préparation du patient et son identification,
le prélèvement des échantillons, leur transport, leur traitement, le choix des examens appropriés à
l’objectif recherché, l’analyse des échantillons, le stockage des échantillons ainsi que l’interprétation des
résultats, l’édition du compte rendu et les prestations de conseils aux utilisateurs du laboratoire.
Deleted: utilizateurs
La communication des résultats au patient, la gestion d’examens en urgence et la notification des
résultats critiques peuvent aussi faire partie de ses activités.
Même si le présent document est destiné à être appliqué aux différentes disciplines reconnues exercées
dans les laboratoires médicaux, il peut également être appliqué à d’autres secteurs de soins de santé, tels
que l’imagerie médicale, les services d’exploration fonctionnelle respiratoire, les laboratoires de
physiologie médicale, les banques de sang et les centres de transfusion sanguine.
L’application du présent document facilite la coopération entre les laboratoires médicaux et les autres
services de santé, l’échange d’informations et l’harmonisation des méthodes et des procédures. Deleted: l’harmonization
Lorsque les laboratoires médicaux se conforment au présent document, la comparabilité des résultats
d’examen des patients entre les laboratoires médicaux est facilitée, quels que soient la ville et le pays
dans lesquels ils sont situés.
Lorsqu’un laboratoire souhaite se faire accréditer, il convient qu’il choisisse un organisme d’accréditation
qui fonctionne conformément à l’ISO/IEC 17011 et qui prend en considération les exigences particulières
des laboratoires médicaux.
Les comparaisons entre le présent document, l’ISO 9001:2015 et l’ISO/IEC 17025:2017 sont présentées
dans l’Annexe B. La comparaison entre l’ISO 15189:2012 et l’ISO 15189:2022 (le présent document) est
Deleted: l’Annexe B.
présentée dans l’Annexe C.
Deleted: 20—
Deleted: l’Annexe C.
Première édition en cours d’élaboration (l’édition précédente était une Spécification technique). Stade au moment
de la publication : ISO/DIS 20658:2022.
Deleted: PROJET FINAL DE NORME INTERNATIONALE
...
Laboratoires médicaux — Exigences concernant la qualité et la
compétence
1 Domaine d'application Deleted: d’application
Le présent document spécifie les exigences concernant la qualité et la compétence des laboratoires
médicaux (laboratoires de biologie médicale et autres laboratoires médicaux comme les structures
d’anatomie et de cytologie pathologiques).
Le présent document est également applicable aux laboratoires médicaux dans le cadre de l’élaboration
de leur système de management et de l’évaluation de leur compétence. Il est également applicable par les
utilisateurs des laboratoires, les autorités réglementaires et les organismes d’accréditation pour Deleted: utilizateurs
confirmer ou reconnaître la compétence des laboratoires médicaux.
Le présent document est applicable aux examens de biologie médicale délocalisée (EBMD). Deleted: délocalizée
NOTE Des réglementations ou exigences internationales, nationales ou régionales peuvent également
s’appliquer à des sujets spécifiques traités dans le présent document.
2 Références normatives
Les documents suivants sont cités dans le texte de sorte qu’ils constituent, pour tout ou partie de leur
contenu, des exigences du présent document. Pour les références datées, seule l’édition citée s’applique.
Pour les références non datées, la dernière édition du document de référence s’applique (y compris les
éventuels amendements).
ISO/IEC Guide 99:2007, Vocabulaire international de métrologie — Concepts fondamentaux et généraux et Deleted: International vocabulary of metrology — Basic
and general concepts and associated terms
termes associés (VIM)
NOTE Le Guide ISO/IEC 99 est également connu sous la référence «JCGM 200», du nom du Comité commun
pour les guides en métrologie («Joint Committee for Guides in Metrology»).
ISO/IEC 17000:2020, Évaluation de la conformité — Vocabulaire et principes généraux Deleted: Conformity assessment — Vocabulary and
general principles…
ISO/IEC 17025:2017, Exigences générales concernant la compétence des laboratoires d'étalonnages et
Deleted: General requirements for the competence of
testing and calibration laboratories
d'essais
3 Termes et définitions
Pour les besoins du présent document, les termes et définitions donnés dans le Guide ISO/IEC 99 et dans
l’ISO/IEC 17000, ainsi que les suivants s’appliquent.
L’ISO et l’IEC tiennent à jour des bases de données terminologiques destinées à être utilisées en
Deleted: utilizées
normalisation, consultables aux adresses suivantes:
Deleted: normalization
— ISO Online browsing platform: disponible à l’adresse https://www.iso.org/obp;
Deleted: —
— IEC Electropedia: disponible à l’adresse https://www.electropedia.org/.
Deleted: —
3.1
biais
biais de mesure
estimation d’une erreur systématique
Note 1 à l'article: Cette définition s’applique uniquement à des mesurages quantitatifs.
Deleted: à l’article:
[SOURCE: Guide ISO/IEC 99:2007, 2.18, modifié — La Note 1 à l’article a été ajoutée.]
Deleted: © ISO 2022 – Tous droits réservés
...
3.2
intervalle de référence biologique
intervalle de référence
intervalle spécifié de la distribution des valeurs prises d’une population de référence biologique
Note 1 à l'article: Un intervalle de référence est couramment défini comme l’intervalle central de 95 %. Dans des cas
Deleted: l’article:
particuliers, une autre taille ou une forme asymétrique de l’intervalle de référence pourrait être plus appropriée.
Note 2 à l'article: Un intervalle de référence peut dépendre du type d’échantillon primaire (3.25) et de la méthode
Deleted: l’article:
d’analyse (3.9) utilisés.
Deleted: (3.25)
Deleted: (3.9) utilizés
Note 3 à l'article: Dans certains cas, seule une limite de référence biologique est importante, en général une limite
supérieure, «x», afin que l’intervalle de référence biologique correspondant soit inférieur ou égal à «x».
Deleted: l’article:
Note 4 à l'article: Les termes tels que «étendue normale», «valeurs normales» et «domaine clinique» sont ambigus
Deleted: l’article:
et donc déconseillés.
[SOURCE: ISO 18113-1:2022, 3.1.9, modifié — L’EXEMPLE a été supprimé.] Deleted: 2009
Deleted: 7
3.3
Deleted: . La Note 5 à l’article a été supprimée.]
limite de décision clinique
résultat d’examen (3.8) signalant un risque accru de conséquences cliniques négatives ou diagnostiquant Deleted: (3.8)
la présence d’une pathologie spécifique
Note 1 à l'article: Les limites de décision clinique pour le dosage des médicaments sont appelées
Deleted: l’article:
«index thérapeutique».
Note 2 à l'article: La limite de décision clinique est utilisée pour déterminer le risque de maladie, à des fins de
Deleted: l’article:
diagnostic ou de traitement.
Deleted: utilizée
3.4
commutabilité d’un matériau de référence
commutabilité
propriété d’un matériau de référence, exprimée par l’étroitesse de l’accord entre, d’une part, la relation
entre les résultats de mesure obtenus pour une grandeur déterminée de ce matériau en utilisant deux
procédures de mesure données et, d’autre part, la relation entre les résultats de mesure pour d’autres
matériaux spécifiés
Note 1 à l'article: Le matériau de référence en question est généralement un é
...
NORMA ISO
INTERNACIONAL 15189
Traducción oficial
Cuarta edición
2022-12
Official translation
Traduction officielle
Laboratorios clínicos — Requisitos
para la calidad y la competencia
Medical laboratories — Requirements for quality and competence
Laboratoires médicaux — Exigences concernant la qualité et la
compétence
Publicado por la Secretaría Central de ISO en Ginebra, Suiza, como
traducción oficial en español avalada por el Translation
Management Group, que ha certificado la conformidad en relación
con las versiones inglesa y francesa.
Número de referencia
DOCUMENTO PROTEGIDO POR COPYRIGHT
© ISO 2022
Reservados los derechos de reproducción. Salvo prescripción diferente, no podrá reproducirse ni utilizarse ninguna parte de
esta publicación bajo ninguna forma y por ningún medio, electrónico o mecánico, incluidos el fotocopiado, o la publicación en
Internet o una Intranet, sin la autorización previa por escrito. La autorización puede solicitarse a ISO en la siguiente dirección o al
organismo miembro de ISO en el país solicitante.
ISO copyright office
CP 401 • Ch. de Blandonnet 8
CH-1214 Vernier, Geneva
Phone: +41 22 749 01 11
Email: copyright@iso.org
Website: www.iso.org
Publicado en Suiza
Version espanola publicada en 2023
Traducción oficial/Official translation/Traduction officielle
ii
Índice Página
Prólogo . vi
Prólogo de la versión en español.vii
Introducción .viii
1 Objeto y campo de aplicación . 1
2 Referencias normativas . 1
3 Términos y definiciones .1
4 Requisitos generales . 8
4.1 Imparcialidad . 8
4.2 Confidencialidad . 9
4.2.1 Gestión de la información . 9
4.2.2 Liberación de la información . 9
4.2.3 Responsabilidad del personal . 9
4.3 Requisitos relativos a los pacientes . 9
5 Requisitos estructurales y de gobernanza .10
5.1 Entidad legal . 10
5.2 Director del laboratorio . 10
5.2.1 Competencia del director del laboratorio . 10
5.2.2 Responsabilidades del director del laboratorio . 10
5.2.3 Delegación de obligaciones . 10
5.3 Actividades del laboratorio . 11
5.3.1 Generalidades . 11
5.3.2 Cumplimiento de los requisitos. 11
5.3.3 Actividades de asesoramiento . 11
5.4 Estructura y autoridad . 11
5.4.1 Generalidades . 11
5.4.2 Gestión de la calidad . 11
5.5 Objetivos y políticas . 12
5.6 Gestión del riesgo .12
6 Requisitos de los recursos .12
6.1 Generalidades .12
6.2 Personal . 13
6.2.1 Generalidades . 13
6.2.2 Requisitos de la competencia . 13
6.2.3 Autorización . 13
6.2.4 Formación continua y desarrollo profesional . 14
6.2.5 Registros del personal . 14
6.3 Instalaciones y condiciones ambientales . 14
6.3.1 Generalidades . 14
6.3.2 Controles de la instalación . 14
6.3.3 Instalaciones de almacenamiento . 15
6.3.4 Instalaciones para el personal . 15
6.3.5 Instalaciones de toma de muestras . 15
6.4 Equipamiento .15
6.4.1 Generalidades .15
6.4.2 Requisitos del equipamiento . 16
6.4.3 Procedimiento de aceptación del equipamiento . 16
6.4.4 Instrucciones de uso del equipamiento . 16
6.4.5 Mantenimiento y reparación del equipamiento . 16
6.4.6 Notificación de incidentes adversos del equipamiento . 17
6.4.7 Registros del equipamiento . 17
6.5 Calibración y trazabilidad metrológica del equipamiento . 17
6.5.1 Generalidades . 17
Traducción oficial/Official translation/Traduction officielle
iii
6.5.2 Calibración del equipamiento . 18
6.5.3 Trazabilidad metrológica de los resultados de medición . 18
6.6 Reactivos y materiales consumibles . 19
6.6.1 Generalidades . 19
6.6.2 Reactivos y materiales consumibles — Recepción y almacenamiento . 19
6.6.3 Reactivos y materiales consumibles — Pruebas de aceptación . 19
6.6.4 Reactivos y materiales consumibles — Gestión del inventario .20
6.6.5 Reactivos y materiales consumibles — Instrucciones de uso .20
6.6.6 Reactivos y materiales consumibles — Notificación de incidentes adversos .20
6.6.7 Reactivos y materiales consumibles — Registros . 20
6.7 Acuerdos de prestación de servicios . 20
6.7.1 Acuerdos con usuarios del laboratorio . 20
6.7.2 Acuerdos con operadores de POCT . 21
6.8 Productos y servicios proporcionados externamente . 21
6.8.1 Generalidades . 21
6.8.2 Laboratorios de derivación y consultores . 21
6.8.3 Revisión y aprobación de productos y servicios proporcionados
externamente . 21
7 Requisitos del proceso .22
7.1 Generalidades .22
7.2 Procesos preanalíticos . 22
7.2.1 Generalidades .22
7.2.2 Información del laboratorio para pacientes y usuarios .22
7.2.3 Solicitudes de análisis al laboratorio . 23
7.2.4 Toma y manipulación de la muestra primaria .23
7.2.5 Transporte de la muestra .
...

















Questions, Comments and Discussion
Ask us and Technical Secretary will try to provide an answer. You can facilitate discussion about the standard in here.